Рекомендации по забору крови у водных и наземных видов черепах: места венепункции и антикоагулянты
АННОТАЦИЯ:
Цель. Оценить различные точки венепункции и использование двух различных антикоагулянтов для получения образцов крови у черепах.
Материалы и методы. Были отобраны 82 особи черепах видов Trachemys callirostris, Podocnemis unifilis и Chelonoidis carbonaria. Оценивали три точки венепункции: субкарапаксный венозный синус, дорсальная копчиковая вена и яремная вена. Испытывали два антикоагулянта: гепарин натрия и ЭДТА.
Результаты. Яремная вена оказалась лучшим местом для проведения венепункции, так как полученные образцы крови не сопровождались гемодилюцией и имели достаточный объем для проведения анализа крови. В отличие от образцов крови, взятых из ярёмной вены, образцы из других точек венепункции обычно были гемодилюцированы. При хранении образцов крови из C. carbonaria с ЭДТА (40 мкл/мл крови) наблюдался гемолиз, чего не наблюдалось при использовании в качестве антикоагулянта гепарина натрия (100 ЕД/мл крови).
Выводы. Ярёмная вена является наиболее рекомендуемым местом венепункции для забора образцов крови в клинических целях. Гепарин натрия является лучшим антикоагулянтом для хранения образцов крови, поскольку он не вызывает гемолиза ни в одном образце.
Ключевые слова: Антикоагулянты; биохимия крови; гематология; Chelonoidis carbonaria; Podocnemis unifilis; Trachemys callirostris.
ВВЕДЕНИЕ:
Черепахи, как и крокодилы, являются наиболее угрожаемой группой рептилий в Колумбии, поскольку некоторые виды используются в качестве источника пищи, домашних животных или для выделки кожи (1). Эти факторы, в дополнение к последствиям уничтожения среды обитания, незаконного оборота этих животных и инфекционных заболеваний, которые обычно поражают рептилий, способствует резкому сокращению их популяции (2). Согласно Reptile Database, в Колумбии обитает 36 видов черепах, из которых 94,4% ведут водный образ жизни. К 2015 году 37% видов черепах в Колумбии находились в той или иной категории угрозы исчезновения; и, к сожалению, несколько видов ещё не категоризированы (1).
В связи с большим разнообразием черепах в Колумбии и постоянной угрозой их незаконной торговли многие особи часто находят приют в центрах спасения диких животных. Клиническое исследование и соответствующее лечение спасённых животных осуществляет Центр спасения и реабилитации диких животных (Unidad de Rescate y Rehabilitación de Animales Silvestres, URRAS) при Национальном университете Колумбии (Universidad Nacional de Colombia). Клиническая оценка состояния этих рептилий проводится с помощью физикального осмотра, методов визуальной диагностики, гематологических тестов и биохимии крови (3). В идеале для анализируемых образцов должны быть предварительно установлены референсные значения, однако для большинства видов черепах в Колумбии не существует стандартных диапазонов и значений, поскольку единственным видом в этой стране, для которого существуют гематологические референсные параметры, является Trachemys callirostris (4,5). В Неотропиках имеются гематологические отчеты только для пяти видов черепах: Podocnemis expansa, Phrynops geoffroanus, Eretmochelys imbricata, Chelonoidis chathamensis и C. denticulata (6,7,8,9,10,11,12).
Определяющим фактором для получения референтных значений гематологических показателей по лабораторным тестам является качество образца. Однако извлечение образцов крови у черепах может быть затруднено из-за анатомических различий между видами, наличия
защитных кожных структур, таких как панцирь и чешуя, сложности манипуляций из-за физической силы особей, трудного расположения и визуализации вен и венозных синусов, а также близости мест венепункции к различным лимфатическим сосудам (13). Контаминация крови лимфой является одним из наиболее частых препятствий для получения образцов крови для лабораторных анализов (14). Другим внешним фактором, влияющим на качество образца, является используемый антикоагулянт (15).
Цель данной статьи - оценка различных точек венепункции, а также подходящий антикоагулянт для забора и сохранения образцов крови у черепах Podocnemis unifilis, Trachemys callirostris и Chelonoidis carbonaria, позволяющих провести оптимальный анализ гематологических показателей и биохимического состава крови.
МАТЕРИАЛЫ И МЕТОДЫ:
Этические положения. Комитет по этике факультета наук Национального университета Колумбии одобрил данное исследование актом 03-2019 от 1 апреля 2019 г. Отбор проб проводился под наблюдением ветеринарных врачей, специализирующихся на животных дикой природы, чтобы гарантировать безопасность отобранных для исследования особей. Кроме того, данное исследование проводилось в соответствии с Законом 84 от 1989 г. Конгресса Республики Колумбия, определяющим национальные правила защиты животных. При этом соблюдались правила, установленные Резолюцией 8430 от 1993 г. Министерства здравоохранения, регулирующей проведение биомедицинских исследований с участием животных.
Отбор проб. Мы отобрали черепах видов Podocnemis unifilis (N=8), Trachemys callirostris (N=43) и Chelonoidis carbonaria (N=31). Размер выборки и выбранные виды зависели от наличия особей в отделении спасения и реабилитации животных (URRAS) факультета ветеринарной медицины и зоотехнии Национального университета Колумбии в Боготе (2,555 метров над уровнем моря, средняя температура: 14°C). Черепахи были приучены к средней искусственной температуре окружающей среды 30°C.
Оценка точек венепункции. Венопункцию проводили в соответствии с рекомендациями, предложенными Naguib(13) и Perpiñan (16) для забора крови у черепах. Во всех случаях использовались шприцы без антикоагулянтов, соединенные с иглами 25G длиной 1 дюйм (2,4 см). Каждая точка предварительно дезинфицировалась хлоргексидином. Объем забираемой крови рассчитывался исходя из веса особи и не превышал 1% от соотношения веса и объема (w/v) каждого животного. После получения образца на места венепункции оказывалось умеренное давление во избежание образования гематом. Ниже перечислены точки венепункции, которые оценивались:
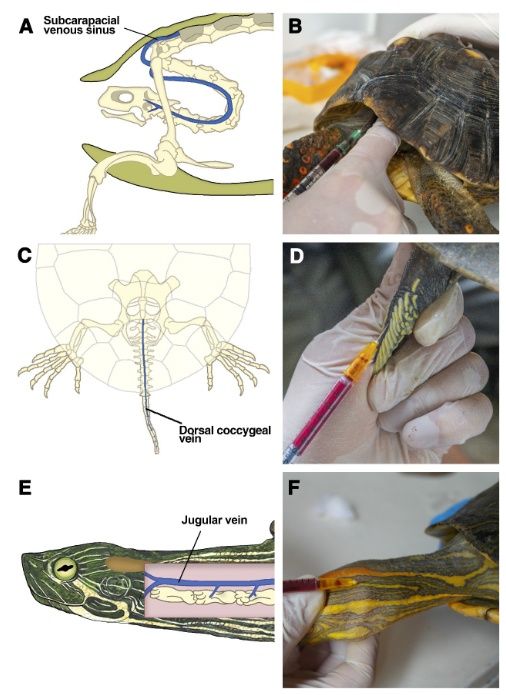
A) Подкарапаксный венозный синус является местом слияния многочисленных сосудов. Он расположен на средней линии туловища животного, где восьмой шейный позвонок соединяется с панцирем (17) (рис. 1А). Доступ к этой точке осуществляется либо при втянутой в панцирь голове животного, либо же при вытянутой голове, наклонённой вниз(17). Иглу следует вводить по средней линии дорсальной поверхности шеи, вблизи границы кожи и панциря в каудодорсальном направлении (рис. 1Б). При касании позвонка иглу следует слегка сдвинуть в краниальном направлении (16).
B) Дорсальная копчиковая вена расположена вдоль средней линии хвоста черепахи (рис. 1С). Для доступа к этой точке иглу необходимо вводить под наклоном от 45° до 60° (17). Поскольку эти вены прилегают к позвонкам, мы рекомендуем вводить иглу до касания позвонка, а затем медленно вынимать ее и создавать отрицательное давление в шприце до тех пор, пока кровь не будет взята (рис. 1D) (18).
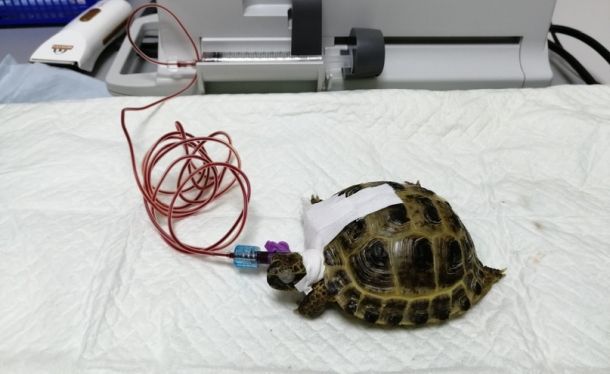
C) Ярёмную вену проходит по латеральной стороне шеи животного, на уровне барабанной перепонки (рис. 1E) (19). Иглу следует вводить поверхностно, параллельно шее в каудальном направлении (рис. 1F) (16).
Хранение образцов крови. После взятия пробы крови её помещали в пластиковые пробирки, содержащие антикоагулянт. Оценивались два антикоагулянта: гепарин натрия (Liquemine®, Roche) в концентрации 100 ЕД/мл крови (20) и этилендиаминтетрауксусная кислота (ЭДТА, Químicos Albor) в концентрации 40 мкл/мл крови, рекомендуемой компанией. До проведения гематологического анализа кровь хранилась при 4°C и анализировалась в течение не более 18 часов с момента взятия пробы. Антикоагулянт оценивали, делая мазки крови через 12 ч хранения, а затем просматривали их под микроскопом для определения целостности клеток крови. Для этого также проводилось макроскопическое исследование крови.
Гематологический анализ. Для оценки влияния места венепункции на качество пробы были отобраны пробы от 15 особей Trachemys callirostris, у каждой из трёх точек венепункции. Анализировались такие гематологические показатели, как гематокрит, гемоглобин и количество эритроцитов (RBC). Процент гематокрита определяли путем центрифугирования крови методом микрогематокрита при 12000 g в течение 5 минут. Количественное определение гемоглобина проводили на спектрофотометре BTS-350 (BioSystem S.A., Барселона). - Испания). Подсчёт эритроцитов проводился вручную в камере Нейбауэра с использованием раствора Натта-Херрика в разведении 1:100 (21).
Статистический анализ. Статистический анализ полученных данных проводился с использованием пакета R commander версии 2.6-2 программного обеспечения R версии 4.0.3 (2020). Использовался тест нормальности Шапиро-Уилка. Затем был проведен дисперсионный анализ с использованием однофакторного ANOVA при уровне значимости 95% для сравнения зависимых переменных (гематокрит, гемоглобин и РГР) и независимых переменных (места венепункции).
Рисунок 1. Оценка мест венепункции. A. Расположение субкарапаксного венозного синуса, B. Забор крови из субкарапаксного венозного синуса у черепахи вида Chelonoidis carbonaria. C. Расположение дорсальной копчиковой вены, D. Забор крови из дорсальной копчиковой вены у черепахи вида Podocnemis unifilis, E. Расположение ярёмной вены (модифицировано из Innis & Knotek (17)), F. Забор крови из яремной вены у черепахи вида Trachemys callirostris.
РЕЗУЛЬТАТЫ:
Оценка точек венепункции. Оцениваемые места венепункции имели следующие характеристики:
Субкарапаксный венозный синус. Точка была легко доступна для получения крови, особенно у очень активных особей, когда манипуляции с конечностями или головой были сложными. Однако, учитывая близость к лимфатическим сосудам, вероятность контаминации лимфой возрастала, что было заметно макроскопически, так как контаминированные образцы имели бледную и светло-красноватую окраску, в отличие от темной насыщенно-красной окраски образцов без гемодилюции. Такое разбавление делало эти образцы непригодными для гематологического и биохимического анализа крови.
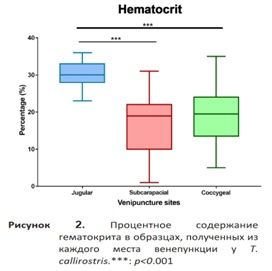
Дорсальная копчиковая вена. Некоторые образцы можно было получить из этой точки, однако манипуляции с ней сложны из-за подвижности и силы хвоста черепахи. Около 50% образцов, проанализированных в ходе исследования, были в той или иной степени гемодилюированы (рис. 2).
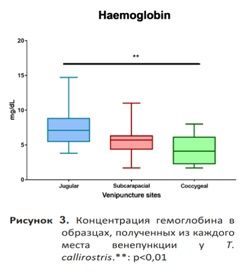
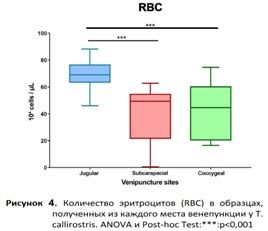
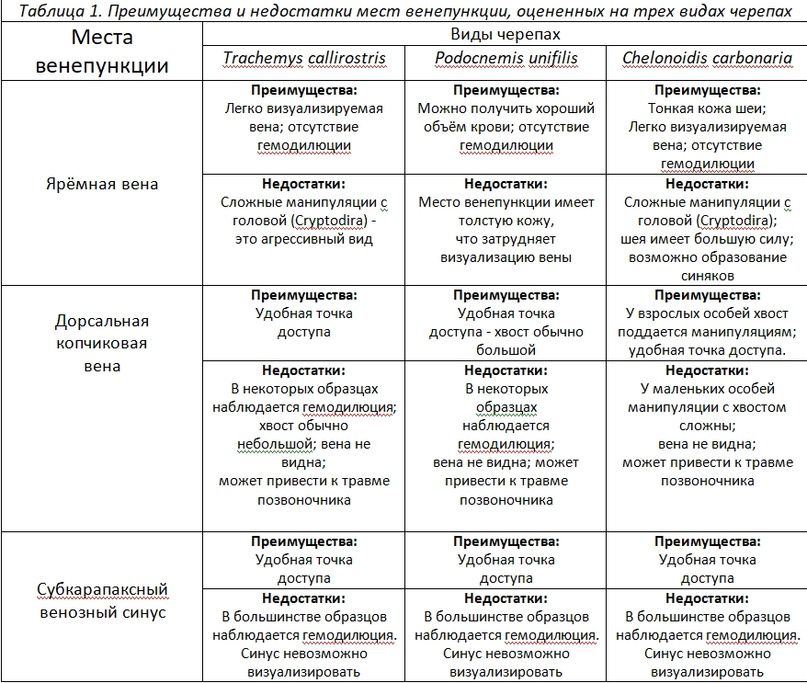
Ярёмная вена. Из-за втягивания головы черепахами и силы, которую они для этого прикладывают, доступ к этой вене был затруднен, особенно у представителей подотряда Cryptodira. Однако, как только голова оказывалась под контролем, вена легко визуализировалась и прощупывалась. Образцы крови, полученные из этого места, обычно имели хорошие преаналитические показатели. Они редко были разбавлены лимфой, о чем свидетельствуют результаты анализа концентрации RBC и гемоглобина. Значения, полученные в этой точке венепункции, были значительно выше, чем в других местах (рис. 3 и 4). Ярёмная вена обеспечивала хороший кровоток, и её можно было легко локализировать, но это место венепункции часто сопровождалось образованием гематом. Чтобы избежать этого, необходимо было оказывать умеренное давление на место пункции в течение примерно двух минут после забора крови. Некоторые преимущества и недостатки, отмеченные в каждом месте венепункции, приведены в табл. 1.
Выборка соответствует нормальному распределению (p>0,05 при выполнении теста Шапиро-Уилка). Мы провели тест ANOVA для сравнения переменных, измеренных в разных местах пробоотбора. Тест ANOVA показал значительную разницу между оцениваемыми местами пункции (p<0,01). Тест post-hoc показал, что результаты лабораторных исследований, полученные из яремной вены, отличались от результатов, полученных из субкарапаксного синуса и копчиковой вены, по трём анализируемым переменным (рис. 2, 3 и 4). Исключение составил гемоглобин, по которому существенных различий между образцами, взятыми из ярёмной вены и субкарапаксного синуса, не наблюдалось (рис. 3). Кроме того, на рис. 2, 3 и 4 показано, что результаты, полученные из субкарапаксного венозного синуса (Ht: 16,6% ± 8,8; Hb: 5,6 мг/дл ± 2,2; RBC: 3,96 х 10^5 ± 2,0) и копчиковой вены (Ht: 18.6% ± 8; Hb: 4,4 мг/дл ± 2; RBC: 4.42 x 10^5 ± 1,9), как правило, были ниже, чем показатели, полученные из ярёмной вены (Ht: 30% ± 3,6; Hb: 7,5 мг/дл ± 2,7; РГР: 6,97 х 10^5 ± 0,9).
Хранение образцов крови. Несмотря на использование во время процедуры шприцев без антикоагулянта, не было обнаружено признаков быстрой коагуляции образцов, что позволило posteriori (лат. «по опыту») разделить их по разным ёмкостям - либо в микропробирки с гелем для разделения сыворотки (для биохимического анализа), либо в пробирки с ЭДТА или гепарином натрия (для гематологического анализа).
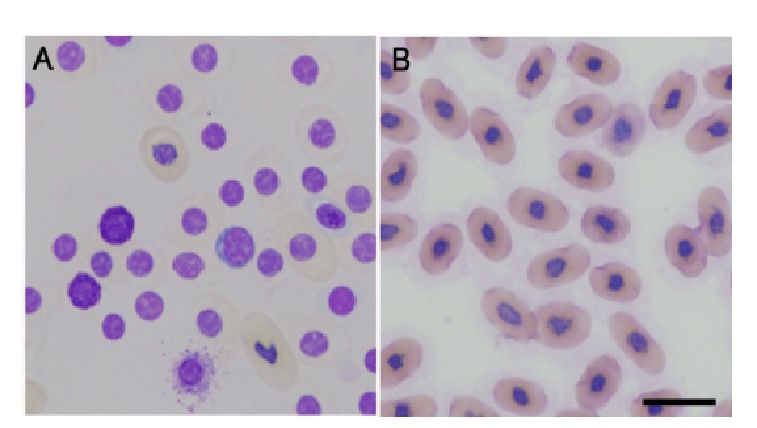
ЭДТА лизировал все образцы крови, полученные от C. carbonaria черепах и препятствовало их апостериорному анализу. Микроскопически через 12 часов после отбора проб в образцах, хранившихся в ЭДТА, наблюдались свободные ядра и гибель эритроцитов - явные признаки лизиса клеток (рис. 5А). И наоборот, в мазках крови, полученных из образцов, хранившихся в гепарине натрия, были обнаружены эритроциты с незначительно нарушенной морфологической целостностью, что проявлялось в неровных цитоплазматических и ядерных границах, а также в слабой окраске (рис. 5Б).
Рис. 5 Кровь Chelonoidis carbonaria через 12 часов после взятия пробы.
А. Кровь антикоагулирована с помощью ЭДТА,
B. Кровь антикоагулирована с помощью гепарина натрия. Штрих: 20 мкм.
Таблица 1. Преимущества и недостатки мест венепункции, оцененных на трёх видах черепах
ОБСУЖДЕНИЕ:
Ярёмная вена оказалась наиболее благоприятной точкой венепункции из трёх рассмотренных, поскольку позволила получить большой объём неразбавленной лимфой крови, достаточный для анализа профиля крови (рис. 2, 3 и 4). Ограничение движения головы может быть сложной задачей из-за силы животных; кроме того, это может быть опасно, учитывая агрессивное поведение и сильный укус некоторых видов черепах, таких как T. callirostris. Имеются сообщения об ампутации конечностей в результате укусов черепах, а последующие инфекции также представляют опасность для врача (22). Легко просматриваемая вена и высокий кровоток делают это место венепункции благоприятным для взятия образцов крови. Это место позволило получить кровь высокого качества и достаточного объема для целей лабораторной диагностики. Таким образом, этот способ забора крови рекомендован к использованию в большей степени, чем другие. Важное наблюдение по данному исследованию, о котором также сообщают Redrobe и MacDonald (18) - ярёмная вена с правой стороны имеет больший размер, что облегчает её визуализацию и пальпацию. Кроме того, вена становится более заметной, если наклонить переднюю часть тела черепахи примерно на 45° вниз.
Как и в работе Redrobe и MacDonald (11), предыдущие отчёты показывают, что быстрое получение хорошего объема крови и низкий риск вторичных инфекций являются одними из основных преимуществ взятия образцов крови у черепах из ярёмной вены (18,23). В различных исследованиях Naguib (13), Perpiñan (16), Mans (19) и Eatwell et al (24) рекомендуется использовать именно этот участок, учитывая низкую вероятность гемодилюции лимфой или её отсутствие.
Дорсальная копчиковая вена может быть хорошей альтернативой для забора крови при работе с крупными особями, поскольку они сильно втягивают голову, что затрудняет доступ к ярёмной вене. Тем не менее дорсальная копчиковая вена может стать проблемным местом для венепункции, поскольку ее близость к лимфатическим сосудам может повысить риск гемодилюции. Манипуляции с хвостом у маленьких особей более сложны, и неправильная пункция может привести к травме спинного мозга, потере подвижности и чувствительности, а также к вторичным эпидуральным инфекциям (18), поэтому брать образцы из этого места не рекомендуется.
Предыдущие исследования также указывают на недостатки использования копчиковой вены в качестве места венепункции у черепах. López-Olvera и др. (25) отмечают значительную гемодилюцию в образцах, полученных из этой точки у окаймлённой сухопутной черепахи (Testudo marginata), что негативно сказывается на анализируемых гематологических и биохимических показателях крови. Выраженная гемодилюция образцов, полученных из дорсальной копчиковой вены, по сравнению с образцами из затылочного синуса, была также отмечена Medeiros et al (26) у T. scripta elegans, что приводит к значительному снижению количества лейкоцитов и концентрации общих белков плазмы. В отличие от этого, Perpiñan и соавт. (27) не обнаружили статистически значимых различий между гематологическими показателями, полученными из дорсальной копчиковой вены по сравнению с субкарапаксным венозным синусом колючего трионикса (Apalone spinifera).
Лёгкий доступ к субкарапаксному венозному синусу является явным преимуществом. Однако, как и при использовании копчиковой вены, вероятность гемодилюции выше по сравнению с использованием яремной вены. В некоторых случаях вначале извлекалась жидкость от бесцветного до слегка жёлтого цвета, вероятно, соответствующая лимфе или интерстициальной жидкости без следов крови. В этих случаях требовался перезабор пробы, что приводило к повышенному стрессу животного. Взятие проб крови для гематологического и биохимического анализа из этого места не рекомендуется из-за изменения показателей крови, вызванного лимфоделюцией (14,25). Если для генетического анализа требуется образец крови, где наличие лимфы или интерстициальной жидкости не представляет неудобств, то субкарапаксный венозный синус является очень благоприятным местом для забора крови из-за простоты обращения с особями и забора их крови.
Помимо места венепункции и качества образца, для правильного хранения крови большое значение имеет выбор антикоагулянта. В связи с этим была проанализирована актуальность использования гепарина натрия и ЭДТА в качестве антикоагулянтов для поддержания крови в оптимальных условиях для проведения гематологического анализа. Хотя ЭДТА обычно используется в качестве антикоагулянта выбора для гематологического анализа, у некоторых видов черепах он вызывает лизис клеток крови, поэтому некоторые авторы рекомендуют использовать гепарин лития для сохранения крови черепах (15). Полученные здесь результаты свидетельствуют о гемолизе клеток крови C. carbonaria хранились с ЭДТА. Хранение образцов крови P. unifilis и T. callirostris в том же антикоагулянте не приводило к гемолизу.
Полученные нами данные подтверждают утверждения Muro и соавт. (15) и Perpiñan и соавт. (27) о гемолитическом действии ЭДТА в образцах крови Testudo hermanni и Apalone spinifera, соответственно. Исследования, проведенные Lyman (28), показали важность кальция в проницаемости эритроцитов Chelydra serpentina (Chelydridae), установив, что при низких концентрациях ионов кальция наблюдается большая проницаемость катионов внутрь эритроцитов, что приводит к гемолизу (28). ЭДТА является хелатирующим агентом кальция, который может вызывать проникновение катионов в эритроциты и привести к их гемолизу. Однако это происходит не у всех видов черепах. По мнению Lyman, C. serpentina считается примитивной черепахой, эритроциты которой зависят от кальция для контроля ионной проницаемости. Эта особенность могла быть утрачена у других видов на протяжении их эволюционной истории (28). Это может объяснить случаи гемолиза, наблюдаемое у C. Carbonaria.
В большинстве исследований в качестве антикоагулянта выбора при хранении крови черепах упоминается литий гепарин. Несмотря на это, гепарин натрия показал благоприятные результаты, сохранив образцы крови всех анализируемых видов в оптимальных условиях. Эти результаты подтверждают другие сообщения, в которых гепарин натрия также использовался для гематологических анализов у черепах вида T. scripta elegans, T. dorbingyi, Podocnemis expansa, Chelonoidis chathamensis, Caretta caretta и Geochelone radiate (11,29,30,31,32,33). В отличие от ЭДТА, гепарин действует путем ингибирования тромбина, что снижает риск гемолиза вследствие хелатирования кальция. Однако, он может мешать окраске по Романовскому, способствуя агглютинации тромбоцитов и лейкоцитов, а также создавая синеватый эффект в мазках крови (24,33). После 12 часов хранения, кровяные клетки С. carbonaria показали небольшие морфологические изменения, которые могли быть вызваны временем экспозиции и эффектами гепарина в составе красителя, который был использован. Поэтому во избежание морфологических изменений рекомендуется делать мазки из свежей крови без антикоагулянта и как можно быстрее. Согласно нашим результатам и предыдущим отчётам, для хранения образцов крови черепах рекомендуется использовать гепарин натрия.
В нашем исследовании речь шла о стратегиях забора образцов крови, позволяющих развивать исследования по установлению гематологических и биохимических параметров крови как у диких животных, так и у особей, содержащихся в неволе. Мы рекомендуем забор крови из ярёмной вены и использование гепарина натрия для последующего хранения и гематологического анализа. Кроме того, мы рекомендуем забор крови из субкарапаксного венозного синуса для исследований, ориентированных на генетику в диких популяциях - кровь можно получить неинвазивным способом, также облегчаются манипуляции с особями и на качество анализа не влияет лимфогемодилюция. Данная работа была проведена на основе отбора проб у трёх видов черепах: Podocnemis unifilis, Trachemys callirostris и Chelonoidis carbonaria, но мы считаем, что учитывая анатомические различия и различия в среде обитания этих черепах, наши результаты могут быть экстраполированы на более широкий круг континентальных черепах.
В заключение следует отметить, что для исследованных видов черепах местом венепункции с наименьшим риском гемодилюции является ярёмная вена, что позволяет получать образцы крови оптимального качества, те, которые могут быть использованы для гематологических анализов и клинической оценки состояния этих особей. Аналогичным образом ЭДТА не оказывала гемолизирующего действия на клетки крови T. callirostris и P. unifilis. Однако в образцах крови, полученных от C. carbonaria, наблюдался гемолизирующий эффект. Образцы крови, хранившиеся с гепарином натрия, были достаточно хорошо сохранены у всех исследованных видов черепах, что облегчало их последующий анализ в лаборатории. Полученные нами данные являются полезной базовой информацией для исследователей дикой природы и ветеринаров реабилитационных центров, не знакомых с процедурой забора образцов крови черепах для лабораторного анализа.
Cristian C. Rodríguez-Almonacid; Carolina M. Vargas-León; Carlos A. Moreno-Torres; Nubia E. Matta C.
Оригинал статьи: www.researchgate.net
Источник: vk.com