Пилотное исследование репаративной регенерации костной ткани панциря молодых особей Trachemys scripta
План строения скелета черепах является эволюционной новинкой развития в связи с формированием специфичного для черепах панцирного гребня, индуцирующего рост рёбер в дорсальном направлении с последующим формированием некоторых пластин экзоскелета. Костные части панциря этих рептилий имеют различный гистогенез: невральные и костальные пластины развиваются по механизму непрямого остеогенеза в виде перихондрального окостенения элементов осевого скелета (позвонков и рёбер); периферальные пластины и пластрон развиваются по механизму прямого остеогенеза в дерме кожи — это так называемые «кожные кости», являющиеся производными отдельных остеогенных клеток за пределами осевого скелета и развивающиеся путем интрамембранного остеогенеза.
Проведён эксперимент по изучению посттравматического остеогенеза костных пластин карапакса пресноводных черепах Trachemys scripta 3-месячного возраста. Сформировано 2 дефекта костальных пластин карапакса диаметром 4 мм и глубиной до фасции с дальнейшим рутинным гистологическим исследованием. Установлено, что уже на 90 сутки костная ткань карапакса черепах восстанавливается с формированием полноценного костного регенерата по механизму первичного остеогенеза.
Введение
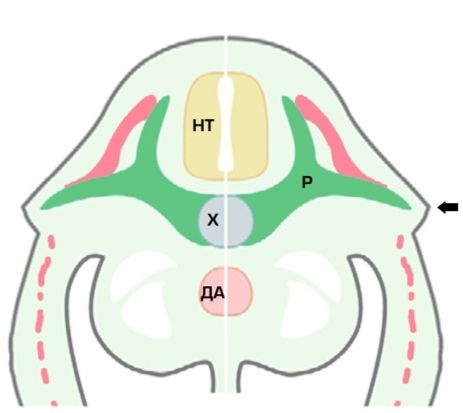
Скелет черепах характеризуется тем, что их рёбра не замыкаются вентрально, а растут в дорсальном направлении и формируют карапакс. К нему с боковой стороны примыкает пластрон (брюшной щит), формируя полноценный панцирь. Это происходит за счёт индуктивного влияния специфичного для черепах мезенхимноэктодермального утолщения — панцирного гребня (рис. 1), направляющего рост рёбер латерально, в отличие от других тетрапод, рёбра которых отклоняются вентрально с образованием замкнутой грудной клетки [1]. При этом плечевой пояс черепах оказывается инкапсулированным в полость тела.
Анализ РНК в области панцирного гребня на ранних стадиях развития выявил сходство в экспрессии генов и транскриптоме между панцирным гребнем и апикальным эктодермальным гребнем — зачатком будущей конечности позвоночных [2–4]. При формировании панцирного гребня выявлена экспрессия уникальных для него генов LEF-1, APCDD1, CRABP-I и Sp5 [2]. Однако клетки панцирного гребня не экспрессируют FGF8 — ген, выполняющий ключевую роль в развитии конечностей позвоночных [5].
Панцирь большинства черепах на различных этапах онтогенеза состоит из 2 элементов: дорсально расположенного карапакса и вентрального пластрона, соединенных между собой боковыми перемычками. Спинной щит представлен так называемыми невральными и костальными пластинами, по бокам к ним примыкают периферальные пластины с образованием карапакса. Пластрон состоит из четырёх парных и одной непарной костной пластины. Поверхность костных пластин покрыта роговыми щитками, представленными многослойным плоским ороговевающим эпителием.
Регенерация «кожных костей» остаётся малоисследованной, но важной для изучения закономерностей эволюционного развития костной ткани. Этот вопрос представляет интерес и с практической точки зрения, так как кости свода черепа человека формируются как отдельные остеогенные дермальные клетки. Первое и единственное доступное исследование репаративной регенерации костной ткани карапакса черепах осуществил Е.С. Данини в 1946 году, выполнив дефект костальных пластин у пресноводной черепахи Emys orbicularis [6].
Цель исследования: изучение посттравматической регенерации костной ткани карапакса молодых пресноводных черепах Trachemys scripta.
Рис. 1. Схема строения эмбриона черепахи (фронтальный срез): НТ — нервная трубка; Х — хорда; ДА — дорсальная аорта; Р — рёбра. Стрелкой отмечен панцирный гребень
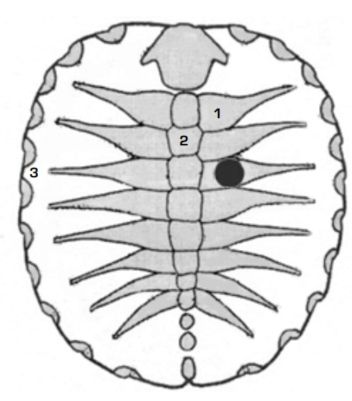
Рис. 2. Схема строения панциря Trachemys scripta: 1 — костальные пластины; 2 — невральные; 3 — периферальные. Область дефекта обозначена чёрным цветом
Материал и методы
В эксперимент включены 5 пресноводных красноухих черепах Trachemys scripta в возрасте 3 месяцев (диаметр карапакса 4 см). Черепахи содержались в аквариуме при температуре воды 24–26 °С. При помощи бора нанесено 2 полнослойных дефекта костальных пластин карапакса диаметром 4 мм на глубину до фасции (рис. 2). Тканевой материал для изучения забирали через 15, 30, 60 и 90 суток. Для гистологического исследования выпиливали участок дефекта, после декальцинации и рутинной пробоподготовки окрашивали гематоксилином и эозином.
Результаты
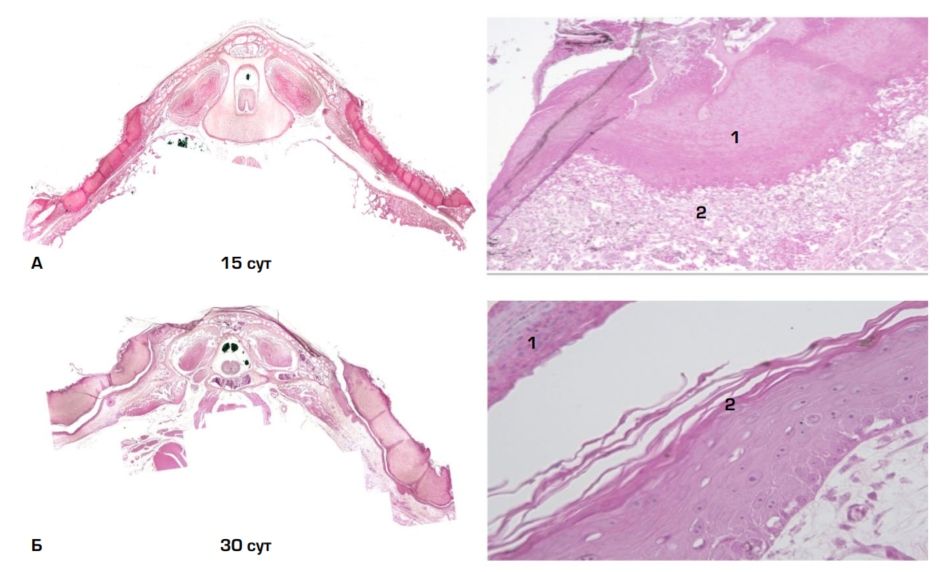
Через 15 суток после повреждения отчётливо заметна граница между зоной некроза с клеточным детритом и граничащей с ней рыхлой волокнистой соединительной тканью дна раны, содержащей большое число кровеносных сосудов с утолщенной стенкой (рис. 3А). Клеточные элементы соединительной ткани представлены преимущественно фибробластами; макрофагально-лейкоцитарной реакции не обнаружено, что свидетельствует о переходе процесса из фазы воспаления в фазу регенерации. Грануляционная ткань низко васкуляризована.
На 30 сутки от начала эксперимента продолжается отторжение поверхностного некротизированного участка и эпителизация раневого дефекта, под которым располагается слой рыхлой волокнистой соединительной ткани (рис. 3Б). Признаков регенерации костной ткани не обнаружено. Эпидермис утолщен и представлен крупными овальными и вытянутыми эпителиальными клетками с гиперхромными ядрами. В раневом дефекте находятся в основном клетки фибробластического дифферона, межклеточное вещество хорошо развито.
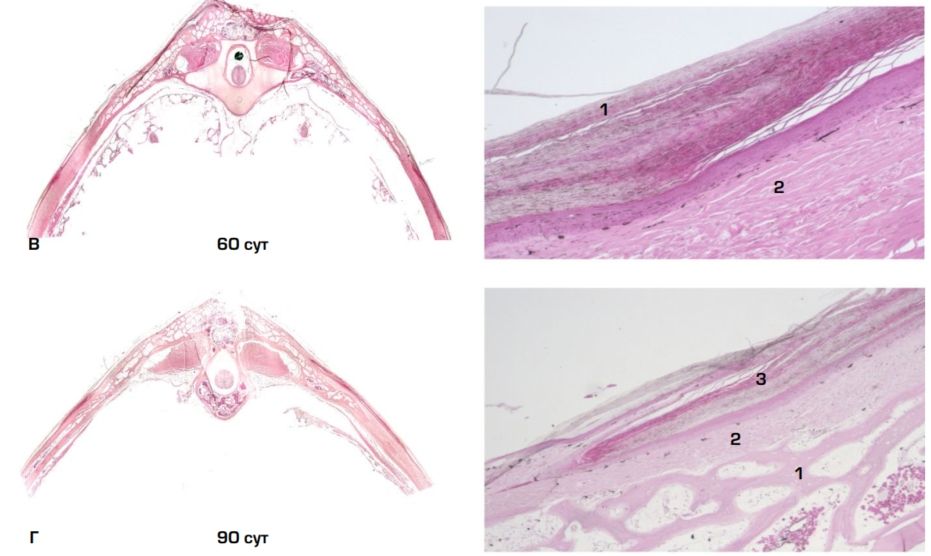
Через 60 суток дефект снаружи полностью покрыт многослойным плоским ороговевающим эпителием под которым располагается слой плотной волокнистой соединительной ткани с неупорядоченным направлением волокон межклеточного матрикса (рис. 3В). Со стороны стенок костного дефекта визуализируется формирование трабекул ретикулофиброзной костной ткани (не показано).
Спустя 90 суток дефект во всём объёме представлен грубоволокнистой костной тканью, четко визуализируются костные трабекулы с остеоцитарными лакунами и кровеносными сосудами (рис. 3Г). Кость покрыта слоем плотной волокнистой соединительной ткани с более упорядоченным направлением волокон, снаружи от которой лежит утолщенный многослойный плоский ороговевающий эпителий. Необходимо отметить, что процесс репаративной регенерации не прекращается на изученном этапе.
Рис. 3. Панцирь, выполненный во фронтальной плоскости в различные по времени сроки: А — 15 сут., 1 — участок некроза, 2 — рыхлая волокнистая соединительная ткань; Б — 30 сут., 1 — отторгающаяся некротизированная ткань, 2 — эпителизация дефекта; В — 60 сут., 1 — утолщенный эпидермис, 2 — плотная волокнистая соединительная ткань; Г — 90 сут., 1 — грубоволокнистая костная ткань, 2 — плотная волокнистая соединительная ткань, 3 — утолщенный эпителий. Ув.: левая колонка ×4; правая колонка ×200
Обсуждение
С эволюционной точки зрения первая костная ткань была сформирована именно в кожном экзоскелете, появившись (по имеющимся данным) в Ордовикский период у вымерших птераспидоморфов в виде аспидина — бесклеточного костного вещества из ткани дентиноидного типа и прилегающей сверху эмали [7]. По мере эволюции организмов отчетливо заметна тенденция к постепенной редукции дентинового слоя и его замена грубоволокнистой костной тканью [8]. Уже у амфибий покровная дентиноподобная ткань почти отсутствует, её редукция сменяется другим процессом, а именно прогрессивным развитием эволюционно самой молодой — пластинчатой костной ткани с характерным остеонным устройством, достигающим своего наибольшего развития в классе млекопитающих [8].
Вопрос гистогенеза составляющих панцирь черепах костных пластин был предметом дискуссий [9–13]. В настоящее время доказано, что невральные и костальные пластины образуются по механизму непрямого остеогенеза в виде перихондрального остеогенеза элементов осевого скелета — позвонков и рёбер [14, 15]. Периферальные и костные пластины пластрона развиваются путём прямого остеогенеза в виде интрамембранного окостенения в дермальном слое кожи [15, 16].
До сих пор не решён вопрос, какой именно клеточный пул преимущественно участвует в гистогенезе пластральных костей. Одни авторы утверждают, что пластрон Trachemys scripta формируется путем миграции клеток стволовой части нервного гребня. В качестве доказательств приводятся иммуногистохимические данные по выявлению белков HNK-1, FoxD3, p75, Runx2, Twist, Msx2 и Sox10, характерных для клеток нервного гребня [17–20]. При этом клетки краниальной части нервного гребня, участвующие в формировании костей черепа человека, экспрессируют такие же белки [21, 22]. Однако такое же исследование у мягкотелой черепахи Pelodiscus sinensis не выявило клеток HNK-1+ [23]. Кроме того, известно, что HNK-1 обнаружен и в субпопуляции лимфоцитов человека — натуральных киллерах, то есть его экспрессия не является патогномоничным маркером клеток нервного гребня.
Опыты Е.С. Данини (1946) с регенерацией костальных пластин панциря у пресноводной черепахи Emys orbicularis длились около 225 дней и за этот срок образования полноценной кости не было обнаружено. До 75 дня после повреждения автор наблюдал процесс активного разрушения костной ткани остеокластами и эпителизацию раны, затем начинался медленный остеогенез с образованием небольшого количества грубоволокнистой костной ткани непосредственно на концах костных трабекул. Итогом работы стало заключение о том, что «размах регенерации кости у черепахи очень небольшой» [6], костная ткань не восстанавливается даже к 225 суткам, когда регенерация прекращается вовсе, что автор связывает с формированием плотной волокнистой соединительной ткани — рубцовой, и периодом спячки у черепах.
Интенсивность регенерации костной ткани зависит от нескольких условий. Ключевым является доступность и развитие кровеносных сосудов в области дефекта [24– 26]. Черепахи являются хладнокровными животными, а следовательно их метаболизм и кровоснабжение зависят от условий внешней среды, особенно от температуры. Поэтому выбран оптимальный для красноухих черепах температурный режим. Помимо этого, на интенсивность репаративных процессов влияют возраст [27] и доступность УФ-излучения [28].
В результате эксперимента установлено, что костная ткань карапакса молодых пресноводных черепах Trachemys scripta обладает способностью к посттравматической регенерации с восстановлением исходной структуры. Учитывая различный гистогенез слагающих панцирь костей, представляется интересным оценить их регенерацию в зависимости от гистогенеза, в частности изучить регенераторный потенциал так называемых «кожных костей» (пластральные и периферальные пластины). Помимо фундаментального, теоретического значения, этот вопрос имеет под собой конкретное практическое применение — кости свода черепа человека имеют такие же дермальные окостенения, поэтому дальнейшее гистологическое и генетическое изучение их регенерации создаёт предпосылки для клеточной и генной терапии краниофациальных заболеваний и индукции репаративного остеогенеза. Для этого необходим более глубокий анализ эмбриологических данных о клеточных популяциях, их дифференцировке, миграции и будущей судьбе.
1. Burke A.C. Development of the turtle carapace: implications for the evolution of a novel bauplan. J. Morph. 1989; 199: 363–78.
2. Kuraku S., Usuda R., Kuratani S. Comprehensive survey of carapacial ridge-specific genes in turtle implies co-option of some regulatory genes in carapace evolution. Evol. Dev. 2005; 7: 3–17.
3. Moustakas J.E. Development of the carapacial ridge: implications for the evolution of genetic networks in turtle shell development. Evol. Dev. 2008; 10: 29–36.
4. Kaplinsky N.J., Gilbert S.F., Cebra-Thomas J. et al. The Embryonic Transcriptome of the Red-Eared Slider Turtle. PLoS One 2013; 8: e66357.
5. Loredo G.A., Brukman A., Harris M.P. et al. Development of an evolutionarily novel structure: fibroblast growth factor expression in the carapacial ridge of turtle embryos. J. Exp. Zool. 2001; 291(3): 274–81.
6. Данини Е.С. Гистологические наблюдения над регенерацией кости щита черепахи Emys Orbicularis L. Изв. АН СССР. Биол. науки 1946; 5: 581–94. [Danini E.S. Histological observations on the regeneration of the shield bone of the turtle Emys Orbicularis L. Bull. USSR Acad. Sci. Biol. Sci. 1946; 5: 581–94].
7. Sire J.Y., Kawasaki K. Origin and evolution of bone and dentin, and of their phosphorylated, acid-rich matrix proteins. In: Goldberg M. (ed.) Frontiers between science and clinic in odontology. 2012; 3–58.
8. Румянцев А.В. Опыт исследования эволюции хрящевой и костной тканей. Изв. АН СССР. 1958. [Rumyantsev A.V. Experience in the study of the evolution of cartilage and bone tissue. Bull. USSR Acad. Sci. 1958].
9. Rathke H. Ueber die Entwicklung der Schildkroten. Braunschweig: Friedrich Vieweg und Sohn 1848; 1–268.
10. Owen R. On the development and the homologies of the carapace and plastron of the chelonian reptiles. Philos. Trans. R. Soc. Lond. 1849; 151–71.
11. Zangerl R. The homology of the shell elements in turtles. J. Morph. 1939; 3: 383–409.
12. Борхвардт В.Г. О природе позвоночных и реберных пластинок панциря черепах. Вестн. Ленингр. ун-та. Сер. биол. 1978; 15: 7–12. [Borkhvardt V.G. On the nature of vertebral and costal plates of the turtle shell. J. Leningr. Univ. Biol. Ser. 1978; 15: 7–12].
13. Rieppel O. Turtles as hopeful monsters. Bioessays 2001; 23: 987–91.
14. Hirasawa T., Nagashima H., Kuratani S. The endoskeletal origin of the turtle carapace. Nat. Commun. 2013; 4: 2107.
15. Черепанов Г.О. Панцирь черепах: происхождение и развитие в онто- и филогенезе [диссертация]. Санкт-Петербург. 2004. [Cherepanov G.O. Turtle shell: origin and development in onto- and phylogenesis [dissertation]. St. Petersburg. 2004].
16. Gilbert S.F., Loredo G.A., Brukman A. et al. Morphogenesis of the turtle shell: the development of a novel structure in tetrapod evolution. Evol. Dev. 2001; 3(2): 47–58.
17. Cebra-Thomas J.A., Betters E., Yin M. et al. Evidence that a lateemerging population of trunk neural crest cells forms the plastron bones in the turtle Trachemys scripta. Evol. Dev. 2007; 9(3): 267–77.
18. Cebra-Thomas J.A., Terrell A., Branyan K. et al. Late-emigrating trunk neural crest cells in turtle embryos generate an osteogenic ectomesenchyme in the plastron. Dev. Dyn. 2013; 242(11): 1223–35.
19. Goldberg S., Venkatesh A., Martinez J. et al. The development of the trunk neural crest in the turtle Trachemys scripta. Dev. Dyn. 2020; 249(1): 125–40.
20. Rice R., Kallonen A., Cebra-Thomas J.A. et al. Development of the turtle plastron, the order-defining skeletal structure. Proc. Nat. Acad. Sci. 2016; 113(19): 5317–22.
21. Siismets E.M., Hatch N.E. Cranial Neural Crest Cells and Their Role in the Pathogenesis of Craniofacial Anomalies and Coronal Craniosynostosis. Dev. Biol. 2020; 8(3): 18.
22. Jamal M., Lewandowski S.L., Lawton M.L. et al. Derivation and characterization of putative craniofacial mesenchymal progenitor cells from human induced pluripotent stem cells. Stem Cell Res. 2018; 33: 100–9.
23. Nagashima H., Shibata M., Taniguchi M. et al. Comparative study of the shell development of hard- and soft-shelled turtles. J. Anat. 2014; 225: 60–70.
24. Hankenson K.D., Dishowitz M., Gray C. et al. Angiogenesis in bone regeneration. Injury 2011; 42(6): 556–61.
25. Hausman M.R., Schaffler M.B., Majeska R.J. Prevention of fracture healing in rats by an inhibitor of angiogenesis. Bone 2001; 29(6): 560–4.
26. Гололобов В.Г. Регенерация костной ткани при заживлении огнестрельных переломов. Санкт-Петербург: Петербург — XXI век; 1997. [Gololobov V.G. Bone tissue regeneration during the healing of gunshot fractures. St. Petersburg: Petersburg — XXI century; 1997].
27. Seifert A.W., Voss S.R. Revisiting the relationship between regenerative ability and aging. BMC Biol. 2013; 11: 2.
28. Ikawa H., Moroi A., Yoshizawa K. et al. Bone regeneration enhancement by ultra-violet (UV) treatment for uHA/PLLA absorbable mesh. J. Craniomaxillofac. Surg. 2017; 45(5): 634–41.
Р.В. Деев, П.С. Подлужный, С.С. Гальков, А.В. Чернораев
Северо-Западный государственный медицинский университет им.И.И. Мечникова, Санкт-Петербург, Россия
Гены и клетки, 2020
Источник и PDF cyberleninka.ru