Групповой случай поражения грибком Fusarium solani молодых головастых черепах (Caretta caretta), выведенных в неволе
Резюме. В качестве источника грибковых инфекций у морских черепах описаны различные дрожжевые и нитчатые грибки. Среди них Fusarium solani вызывает кожные инфекции, поражая ослабленных взрослых животных (выловленных из природных вод) и контаминирует гнезда, в результате чего вид несет огромные потери во время размножения. Наглядно представлена патогенность грибка на примере нашего опыта во время разведения головастых черепах (Caretta caretta), впервые полученных в морском парке Marineland в Антибе в 2010 году и снова получивших приплоды в 2011 и 2013 годах.
У 6 выживших особей (0,9% яиц) первого поколения развились поражения кожи, а также мультифокальные поражения внутренних органов. Микробиологическое исследование образцов позволило установить в качестве этиологического агента F.solani. Противогрибковая терапия позаконазолом спасла 2 особей из 6 (выживаемость 33%). Эпизоотологические исследования, контроль, строгие меры гигиены, создание ранних диагностических критериев и протоколов профилактики и лечения помогали нам предотвращать и более эффективно лечить от инфекции последующие выводки в 2011 и 2013 году (80 особей в общей сложности - 6,6% от кладки), подняв коэффициент выживаемости до 50%. F.solani выступает в качестве основной угрозы для репродукции морских черепах в дикой природе. Отметим, что эта проблема также представляет угрозу для разведения. Факторы передачи и патогенность Fusarium spp. для головастых черепах освещены в данных литературы о взрослых морских черепахах и их гнездах в природе, а также в данных нашего разведения.
Введение
Шесть видов морских черепах, в том числе Caretta caretta, обитающие в Средиземном море и находящиеся под угрозой исчезновения, вероятно, могут поражаться различными поверхностными или глубокими микозами. Среди различных возбудителей основное место занимает Fusarium solani [1,2]. Он вызывает поверхностные и системные поражения у свободноживущих и выловленных для реабилитации взрослых особей, а также поражает гнезда в дикой природе, результатом чего являются массовые потери при размножении. Первые упоминания о возбудителе у черепах датируются 1981 годом у C.caretta на Багамских островах [3], после чего подобные сообщения стали регулярными, например, последнее сообщение Sarmiento-Ramirez et al., 2014 [2]. О черепахах с поражениями кожи и панциря [4,5], а также легких [6] время от времени сообщалось с 1997 года. Мы сообщаем в этой работе о патогенности F.solani в отношении молодых особей C.caretta, полученных первый раз в неволе в 2010 году в морском парке Marineland в Антибе.
ВВЕДЕНИЕ:
Черепахи, как и крокодилы, являются наиболее угрожаемой группой рептилий в Колумбии, поскольку некоторые виды используются в качестве источника пищи, домашних животных или для выделки кожи (1). Эти факторы, в дополнение к последствиям уничтожения среды обитания, незаконного оборота этих животных и инфекционных заболеваний, которые обычно поражают рептилий, способствует резкому сокращению их популяции (2). Согласно Reptile Database, в Колумбии обитает 36 видов черепах, из которых 94,4% ведут водный образ жизни. К 2015 году 37% видов черепах в Колумбии находились в той или иной категории угрозы исчезновения; и, к сожалению, несколько видов ещё не категоризированы (1).
В связи с большим разнообразием черепах в Колумбии и постоянной угрозой их незаконной торговли многие особи часто находят приют в центрах спасения диких животных. Клиническое исследование и соответствующее лечение спасённых животных осуществляет Центр спасения и реабилитации диких животных (Unidad de Rescate y Rehabilitación de Animales Silvestres, URRAS) при Национальном университете Колумбии (Universidad Nacional de Colombia). Клиническая оценка состояния этих рептилий проводится с помощью физикального осмотра, методов визуальной диагностики, гематологических тестов и биохимии крови (3). В идеале для анализируемых образцов должны быть предварительно установлены референсные значения, однако для большинства видов черепах в Колумбии не существует стандартных диапазонов и значений, поскольку единственным видом в этой стране, для которого существуют гематологические референсные параметры, является Trachemys callirostris (4,5). В Неотропиках имеются гематологические отчеты только для пяти видов черепах: Podocnemis expansa, Phrynops geoffroanus, Eretmochelys imbricata, Chelonoidis chathamensis и C. denticulata (6,7,8,9,10,11,12).
Определяющим фактором для получения референтных значений гематологических показателей по лабораторным тестам является качество образца. Однако извлечение образцов крови у черепах может быть затруднено из-за анатомических различий между видами, наличия
защитных кожных структур, таких как панцирь и чешуя, сложности манипуляций из-за физической силы особей, трудного расположения и визуализации вен и венозных синусов, а также близости мест венепункции к различным лимфатическим сосудам (13). Контаминация крови лимфой является одним из наиболее частых препятствий для получения образцов крови для лабораторных анализов (14). Другим внешним фактором, влияющим на качество образца, является используемый антикоагулянт (15).
Цель данной статьи - оценка различных точек венепункции, а также подходящий антикоагулянт для забора и сохранения образцов крови у черепах Podocnemis unifilis, Trachemys callirostris и Chelonoidis carbonaria, позволяющих провести оптимальный анализ гематологических показателей и биохимического состава крови.
Исследование
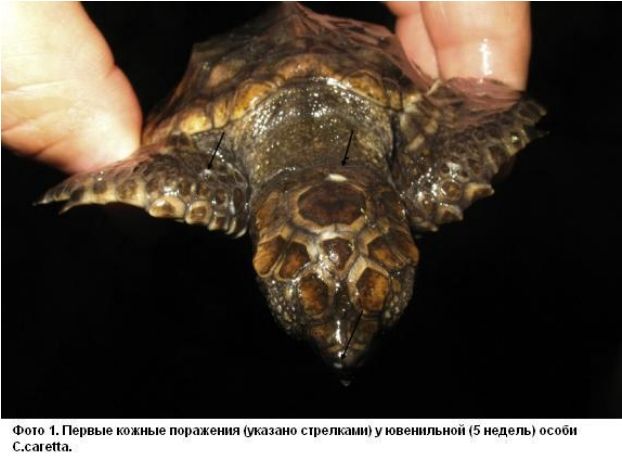
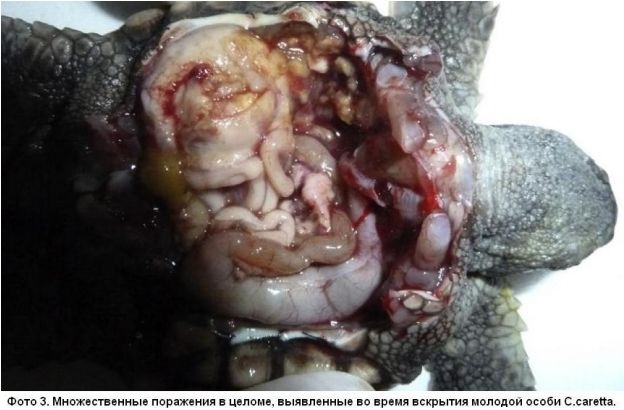
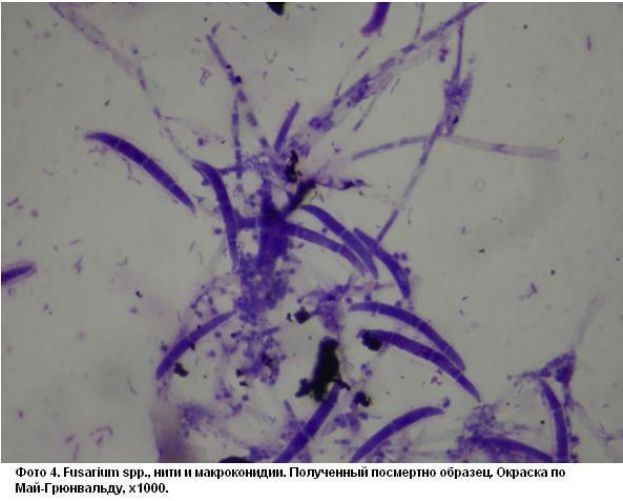
В морском парке Marineland в Антибе содержат черепах C.caretta. В 2010 году регулярное УЗИ этих черепах позволило определить беременность у 2 самок возрастом несколько старше 50 лет. Не смотря на наличие песчаного пляжа в их бассейнах, позволяющего совершить кладку в обстановке, приближенной к естественной, яйца были отложены прямо в воде. Все яйца были собраны, очищены, продезинфицированы хлоргексидином и перенесены на инкубацию в питомник, где за ними осуществлялся постоянный контроль: дезинфекция воздуха и поверхностей, контроль температуры и влажности, а также соблюдение гигиены персоналом при работе. Из 622 яиц собрали все яйца, выглядевшие неповрежденными, 20 оказались оплодотворены и из 6 (0,9%) вылупились молодые черепахи. В течение 8 недель после вылупления снижение аппетита и заметное замедление роста вызвали подозрения об инфекции, подтверждающиеся появлением обширных белесых пушистых очагов на покровах, указывающих на грибковое заболевание (Фото 1 и 2). Несмотря на попытки терапии с применением различных антибиотиков системно и энилконазола местно (раствор 2 мг/мл, 3 раза в день, курсами различной длительности - до 35 дней), 4 черепахи погибли. Вскрытие показало наличие множественных абсцессов в коже, полости рта, легких, печени, сердце и в самом целоме (Фото 3). Во время вскрытия у двух из четырех погибших черепах были взяты образцы для микробиологического исследования. Исследование мазков, окрашенных по Май-Грюнвальду-Гимзе, помогло определить нити мицелия, напоминающие макроконидии Fusarium sp. (Фото 4). Культуральный посев на среде Сабуро с добавлением хлорамфеникола (BBLTM Sabouraud, Becton Dickinson) после инкубации при темературе 30 и 37 градусов по Цельсию позволил за 7 дней получить многочисленные изолированные колонии Fusarium sp., позже идентифицированные, как F.solani при помощи технологии MALDI-TOF [7]. Для подтверждения участия Fusarium sp. в роли возбудителя было проведено лечение в виде подачи позаконазола в дозе 0,02 мг/100 г, 1 раз в день, что позволило спасти оставшихся двух молодых черепах (33%). Выбор терапии был основан на данных посева с определением чувствительности и доступности препарата в подходящей для этих животных лекарственной форме.
Экологическое исследование с повторными микробиологическими тестами образцов воды, воздуха и различных поверхностей в питомнике не смогли помочь определить источник заражения. В ходе проверок места, где проходила инкубация яиц, уязвимостей не было найдено, но гигиенические меры были усилены. Две другие кладки, полученные в 2011 и 2013 годах, имели такое же количество яиц и приплод составил около 80 штук (выживаемость: 3,3%). У большинства из них в скором времени заподозрили фузариоз на основании данных клинического исследования и/или данных компьютерной томографии (Фото 5). Всем животным сразу прописали позаконазол в дозе, указанной выше. Продолжительность лечения составляла в среднем 1 месяц (в некоторых случаях от 15 дней до 3 месяцев). Благодаря этому летальность составила 50%. Из 40 выживших черепах ни у кого не наблюдалось рецидивов и не требовалось терапевтическое лечение в течение 12 месяцев наблюдения, даже если сканирование указывало на наличие остаточных абсцессов. Эти молодые C.caretta в скором времени были переданы другим морским паркам, участвующим в сохранении видов, находящихся под угрозой исчезновения.
Обсуждение
Наши данные, касающиеся ювенильных особей, вылупившихся и выращенных в неволе, дополняют два случая, описанные ранее в литературе (заболевание взрослых особей и поражение кладок в дикой природе). Заболеваниям, вызванным Fusarium spp., у морских черепах могут способствовать три фактора: контаминация окружающей среды, патогенность отдельных штаммов и, наконец, некоторая иммуносупрессия этих животных, повышающая их восприимчивость к этой инфекции.
Fusarium spp. являются повсеместно распространенными грибками-сапрофитами и фитопатогенами. Нередко эти грибки поражают человека, вызывая онхомикоз или, реже, более глубокие поражения [8]. Он не является частью нормальной микрофлоры у морских животных [9,10] и был описан в качестве возбудителя инфекции у многих других пресноводных (пресноводных черепах [11], аллигаторов [12]) или морских (дельфины [10,13,14], ластоногие [10,15], костные рыбы [16,17], акулы [18,19]) животных. В ходе исследования окружающей среды в японском морском парке, похожем на парк Marineland, в котором морские млекопитающие страдали от грибковой инфекции, Fusarium spp. был выделен из образцов, взятых из бассейнов для содержания [20]. Работа Sarmiento-Ramirez et al. с выводком C.caretta в морском заповеднике в Кабо-Верде также показала, что F.solani присутствовал в песчаных гнездах и очень хорошо рос в этих условиях [1,2]. В том случае были инфицированы только те яйца, которые контактировали с песком (крайние в кладке), что позволяет предположить, что источником заражения был именно песок, а не беременные самки [1]. Различные молекулярные исследования подтверждают идентичность штаммов, изолированных из окружающей среды, и штаммов, ответственных за заболевания взрослых черепах и поражения их гнезд [1,9]. С другой стороны, наличие аналогичных штаммов в песке из пораженных и невредимых гнезд привело Сармьенто-Рамиреса с коллегами к предположениям, какие еще факторы, помимо штамма грибка, могут влиять на развитие инфекции: микроклимат гнезда, состав песка и наличие в нем токсинов, вероятность затопления во время прилива, наличие ила [1,2]. В нашем же случае об источнике инфекции можно только догадываться. Мне не нашли возбудителя в окружающей среде, но, возможно, наличие грибков в окружающей среде является непостоянным и, следовательно, при поиске это вызывает проблемы. Это также предположил Montali с соавторами, описывая кожные повреждения, вызванные Fusarium sp., которые исчезали и возникали вновь у содержащихся в неволе ластоногих, что связано с цикличной распространенностью Fusarium sp., зависящую от колебаний температуры воды и степени ее хлорирования [15]. У молодняка нашего разведения развивалась инфекция, в то время как на оболочках яиц и у зародышей не наблюдалось макроскопических признаков инфекции, что указывает на контаминацию воды после вылупления. Контаминация, однако, может произойти и до вылупления, но оно предупреждается гигиеной и постоянным контролем в питомнике, более низкой плотностью концентрации особей в местах природных кладок или неволи, где концентрация особей в популяции ниже, чем в случае сообщения о фузариозе [21-26]. Сармьенто-Рамирес с коллегами в ходе исследования на черепашьих яйцах показали вирулентность штаммов, изолированных с гнезд C.caretta в Кабо-Верде [1]. В более поздней работе они указали на то, что возникновение заболевания связано с F.keratoplasticum и F.falciforme, а также, собственно, с подвидами F.solani [2]. Сейчас сообщения о штаммах, приспособившихся к водной среде, с одинаковой частотой встречаются и в медицинских трудах, и в работах по ветеринарии [16,27]. Эти наблюдения совпадают с результатами проведенных ранее исследований, также показавших способность Fusarium spp. существовать в воде [28]. Так, работа Sautour с коллегами от 2012 года показала, что некоторые популяции Fusarium spp., адаптированные к росту в водной среде, оказались устойчивы к различным химическим веществам, применяемым для очистки воды (например, к хлору), что позволяло им колонизировать госпитальные сети водоснабжения [27]. В довесок ко всему, уже известная кератинолитическая способность Fusarium spp. [29], является еще одним фактором патогенности, особенно для черепах с их особенностями [23,24,30]. Одним из предрасполагающих факторов к заболеваниям грибковой, бактериальной и вирусной природы считается охлаждение воды (сезонное или в связи с течениями), которое вынуждает морских черепах перебираться на мелководье [31], где их поимка наиболее легка и нередка, стресс от которой усугубляет ситуацию ослаблением иммунной системы, и без того расшатанную похолоданием [4,5]. Кроме всего прочего, всегда есть вероятность и врожденного иммунодефицита, упомянутого Manire с коллегами в 2002 году в описании случая заражения черепах грибком Colletotrichum acutatum [31]. Предположение о врожденной предрасположенности в некоторой степени объясняет в гнездах, колонизированных F.solani, как наличие заболевания, так и его отсутствие [ 1,2]. Условия для возникновения оппортунистической инфекции не отличаются от таковых у других животных; ворота инфекции могут появляться, например, на месте травмы, как это описано Cabanes с коллегами в 2012 году и Williams с коллегами в 1997 году [4,5]. Так же, как и у людей, ворота инфекции могут появиться на месте повреждения кожи (ожоги, глубокие дерматомикозы, даже постановка катетера) [8]. В легочной форме, а также в проникающих в прочие органы формах ворота инфекции остаются невыясненными точно, но вполне может быть, что легочной формой фузариоза животные заражаются, собственно, путем респираторной передачи [6]. Во всех этих случаях, в нашем в том числе, был необходим комплексный подход и после первой вспышки заболевания были предложены превентивные гигиенические меры. Они включали в себя:
- Клиническое обследование (под особый контроль попадали особи со сниженным аппетитом и внешними поражениями);
- Использование КТ для установления внутренних поражений, их локализации, а также для отслеживания их развития;
- Незамедлительное использование позаконазола по прописи, освещенной выше, во время болезни и дополнительно в течение 14 дней после исчезновения клинических признаков (восстановление аппетита и исчезновение поражений кожного покрова). Использование такого подхода позволило значительно снизить летальность во втором и третьем выводках.
По большому счету, Fusarium spp. может фигурировать в качестве возбудителя заболевания у морских черепах всех видов и во всех районах, где происходит их размножение [2], в том числе и в питомниках. Возникновению инфекции способствует множество факторов, от экологии и патогенности штамма грибка до состояния иммунитета животных. Наш первый опыт с C.caretta заставил нас установить систему профилактических мер, согласно которой мы действовали в двух последующих случаях и добились значительного снижения смертности и передали выращенных животных в другие парки, участвующие в программах по сохранению вымирающих видов животных.
Конфликт интересов
Авторы указывают об отсутствии связей с заинтересованными лицами и организациями.
Благодарность
Мы выражаем благодарность команде врачей и ученых центра исследований в Marineland, фонд Marineland за их преданность общему делу и их участие в программе по сохранению морских черепах C.caretta, а также управление и администрацию центра за их поддержку. Мы благодарим медицинский центр при институте биологии в Антибе за их помощь в виде исследований на их оборудовании.
- Sarmiento-Ramirez JM, Abella E, Martin MP, Telleria MT, Lopez-Jurado LF, Marco A, et al. Fusarium solani is responsible for mass mortalities in nests of loggerhead sea turtle, Caretta caretta, in Boavista, Cape Verde. FEMS Microbiol Lett 2010; 312:192—200.
- Sarmiento-Ramirez JM, Abella-Perez E, Phillott AD, Sim J, van West P, Martin MP, et al. Global distribution of two fungal pathogens threatening endangered sea turtles. PLoS One 2014;9:e85853.
- Rebell G. Fusarium in human and veterinary medicine. In: Nelson PE, Toussoun TA, Cook RJ, editors. Fusarium: diseases biology and taxonomy. University park, PA: The Pennsylvannia State University Press; 1981. p. 210—20.
- Cabanes FJ, Alonso JM, Castella G, Alegre F, Domingo M, Pont S. Cutaneous hyalohyphomycosis caused by Fusarium solani in a loggerhead sea turtle (Caretta caretta L.). J Clin Microbiol 1997;35:3343—5.
- Williams SR, Sims MA, Roth-Johnson L, Wickes B. Surgical removal of an abscess associated with Fusarium solani from a Kemp's ridley sea turtle (Lepidochelys kempii). J Zoo Wildl Med 2012;43:402—6.
- Oros J, Delgado C, Fernandez L, Jensen HE. Pulmonary hyalo-hyphomycosis caused by Fusarium spp. in a Kemp's ridley sea turtle (Lepidochelys kempi): an immunohistochemical study. N Z Vet J 2004;52:150—2.
- Marinach-Patrice C, Lethuillier A, Marly A, Brossas JY, Gene J, Symoens F, et al. Use of mass spectrometry to identify clinical Fusarium isolates. Clin Microbiol Infect 2009;15:634—42.
- Dignani MC, Anaissie E. Human fusariosis. Clin Microbiol Infect 2004;10:67—75.
- Castella G, Cano J, Guarro J, Cabanes FJ. DNA fingerprinting of Fusarium solani isolates related to a cutaneous infection in a sea turtle. Med Mycol 1999;37:223—6.
- Frasca Jr S, Dunn JL, Cooke JC, Buck JD. Mycotic dermatitis in an Atlantic white-sided dolphin, a pygmy sperm whale, and two harbor seals. J Am Vet Med Assoc 1996;208:727—9.
- Jacobson ER, Calderwood MB, Clubb SL. Mucormycosis in hatchling Florida soft-shell turtles. J Am Vet Med Assoc 1980;177:835—7.
- Frelier PF, Sigler L, Nelson PE. Mycotic pneumonia caused by Fusarium moniliforme in an alligator. Sabouraudia 1985;23: 399—402.
- Tanaka M, Izawa T, Kuwamura M, Nakao T, Maezono Y, Ito S, et al. Deep granulomatous dermatitis of the fin caused by Fusarium solani in a false killer whale (Pseudorca crassidens). J Vet Med Sci 2012;74:779—82.
- Staggs L, St Leger J, Bossart G, Townsend Jr FI, Hicks C, Rinaldi M. A novel case of Fusarium oxysporum infection in an Atlantic bottlenose dolphin (Tursiops truncatus). J Zoo Wildl Med 2010;41:287—90.
- Montali RJ, Bush M, Strandberg JD, Janssen DL, Boness DJ, Whitla JC. Cyclic dermatitis associated with Fusarium sp. infection in pinnipeds. J Am Vet Med Assoc 1981;179: 1198—202.
- Hatai K, Kubota SS, Kida N, Udagawa S. Fusarium oxysporum in red sea bream (Pagrus sp.). J Wildl Dis 1986;22:570—1.
- Ostland VE, Ferguson HW, Armstrong RD, Asselin A, Hall R. Granulomatous peritonitis in fish associated with Fusarium solani. Vet Rec 1987;121:595—6.
- Crow GL, Brock JA, Kaiser S. Fusarium solani fungal infection of the lateral line canal system in captive scalloped hammerhead sharks (Sphyrna lewini) in Hawaii. J Wildl Dis 1995; 31:562—5.
- Smith AG, Muhvich AG, Muhvich KH, Wood C. Fatal Fusarium solani in baby sharks. J Med Vet Mycol 1989;27:83—91.
- Kohata E, Kano R, Akune Y, Ohno Y, Soichi M, Yanai T, et al. Environmental isolates of fungi from aquarium pools housing killer whales (Orcinus orca). Mycopathologia 2013;176: 403—8.
- Creeper JH, Main DC, Berger L, Huntress S, Boardman W. An outbreak of mucormycosis in slender tree frogs (Litoria adelensis) and white-lipped tree frogs (Litoria infrafrenata). Aust Vet J 1998;76:761 —2.
- Khoa LV, Hatai K, Aoki T. Fusarium incarnatum isolated from black tiger shrimp, Penaeus monodon Fabricius, with black gill disease cultured in Vietnam. J Fish Dis 2004;27:507—15.
- Nardoni S, Lungonelli P, Papini R, Mugnaini L, Mancianti F. Shell mycosis in a group of Hermann's tortoises (Testudo hermanni). Vet Rec 2012;170:76.
- Rose FL, Koke J, Koehn R, Smith D. Identi fication of the etiological agent for necrotizing scute disease in the Texas tortoise. J Wildl Dis 2001;37:223—8.
- Perpinan D, Trupkiewicz JG, Armbrust AL, Geiser DM, Armstrong S, Garner MM, et al.
- Dermatitis in captive Wyoming toads (Bufo baxteri) associated with Fusarium spp.. J Wildl Dis 2010;46:1185—95.
- Salter CE, O'Donnell K, Sutton DA, Marancik DP, Knowles S, Clauss TM, et al. Dermatitis and systemic mycosis in lined seahorses Hippocampus erectus associated with a marine-adapted Fusarium solani species complex pathogen. Dis Aquat Organ 2012;101:23 —31.
- Sautour M, Edel-Hermann V, Steinberg C, Sixt N, Laurent J, Dalle F, et al. Fusarium species recovered from the water distribution system of a French university hospital. Int J Hyg Environ Health 2012;215:286—92.
- Wadhwani K, Srivastava AK. Fungi from otitis media of agri-cultural field workers. Mycopathologia 1984;88:155—9.
- Galletti J, Negri M, Grassi FL, Kioshima-Cotica ES, Svidzinski TI. Fusarium spp. is able to grow and invade healthy human nails as a single source of nutrients. Eur J Clin Microbiol Infect Dis 2015;34(9):1767-72 [Epub ahead of print].
- Oros J, Calabuig P, Arencibia A, Camacho M, Jensen H. Systemic mycosis caused by Trichophyton spp. in an olive ridley sea turtle (Lepidochelys olivacea): an immunohistochemic al study. N Z Vet J 2011;59:92—5.
- Manire CA, Rhinehart HL, Sutton DA, Thompson EH, Rinaldi MG, Buck JD, et al. Disseminated mycotic infection caused by Colletotrichum acutatum in a Kemp's ridley sea turtle (Lepidochelys kempi). J Clin Microbiol 2002;40:4273—80.
Garcia-Hartmann3, C. Hennequinb, S. Catteauc C. Beatinid, V. Blanc d’*
aCentre de recherche pour la conservation, Marineland, 306, avenue Mozart, 06600 Antibes, France
b Service de parasitologie-mycologie, hbpital Saint-Antoine, 184, rue du Faubourg-Saint-Antoine, 75571 Paris cede* 12, France
c Fondation Marineland, 306, avenue Mozart, 06600 Antibes, France
dService ae biologie, centre hospitalier d’Antibes, 107, avenue de Nice, 06600 Antibes, France
Перевод с французского: Куторов С.А., ветеринарный врач, Новосибирск.